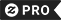Sale prijs € 19,92.
Originele prijs € 26,55 per shirt
Je bespaart 25%
im not luzy i ik heb gewoon niet genoeg enzymen t-shirt
Bekijk productdetailsOver T-shirts
Aangeboden door
Over dit ontwerp
De decoratieve details in het ontwerp zijn nagebootst. Bij de productie van dit product zullen er geen aanvullende materialen worden gebruikt.
im not luzy i ik heb gewoon niet genoeg enzymen t-shirt
Enzymen zijn eiwitten die katalyseren (d.w.z. de snelheid van) chemische reacties verhogen.[1][2] Bij enzymatische reacties worden de moleculen aan het begin van het proces substraten genoemd, en het enzym zet ze om in verschillende moleculen, de producten genoemd. Bijna alle processen in een biologische cel hebben enzymen nodig die in significante mate voorkomen. Aangezien enzymen selectief zijn voor hun substraten en slechts een paar reacties van vele mogelijkheden versnellen, bepaalt de reeks enzymen die in een cel worden gemaakt welke metabolische routes in die cel optreden. Zoals alle katalysatoren werken enzymen door de activeringsenergie (Ea‡) te verlagen voor een reactie, waardoor de reactiesnelheid dramatisch stijgt. Als gevolg hiervan worden producten sneller gevormd en bereiken de reacties sneller hun evenwichtssituatie. De meeste enzymreacties zijn miljoenen malen sneller dan die van vergelijkbare niet-gekatalyseerde reacties. Net als bij alle katalysatoren worden enzymen niet geconsumeerd door de reacties die ze katalyseren, noch veranderen ze het evenwicht van deze reacties. Enzymen verschillen echter van de meeste andere katalysatoren omdat ze veel specifieker zijn. Het is bekend dat enzymen ongeveer 4.000 biochemische reacties katalyseren[3] Een paar RNA-moleculen, ribozymen genaamd, katalyseren ook reacties, waarbij een belangrijk voorbeeld sommige delen van het riboom zijn.[4][5] Synthetische moleculen, kunstmatige enzymen genoemd, vertonen ook enzymatische katalyse.[6] De enzymactiviteit kan door andere moleculen worden beïnvloed. Remmers zijn moleculen die de enzymactiviteit verminderen; activatoren zijn moleculen die de activiteit verhogen . Veel geneesmiddelen en gifstoffen zijn enzymremmers. De activiteit wordt ook beïnvloed door temperatuur, chemische omgeving (bv. pH) en de concentratie van het substraat. Sommige enzymen worden bijvoorbeeld in de handel gebruikt bij de synthese van antibiotica. Bovendien gebruiken sommige huishoudelijke producten enzymen om biochemische reacties te versnellen (bijvoorbeeld enzymen in biologische waspoeders breken eiwitten of vetvlekken op kleding af); enzymen in vleesgevoelige dieren breken eiwitten af, waardoor het vlees gemakkelijker kan kauwen). Inhoud [hide] 1 Etymologie en geschiedenis 2 Structuren en mechanismen 2.1 Specificiteit 2.1.1 "Lock and key" model 2.2 Mechanismen 2.2.1 Transition State Stabilization 2.2.2 Dynamics and function 2.3 Allostere modulatie 3 Cofactoren en co-enzymen 3.1 Coenzymen 3.2 Coenzymen 4 Thermodynamica 5 Kinetics 6 Inremming 7 Biologische functie 8 Controle van activiteit 9 Betrokkenheid bij ziekte 10 Namaakconventies 11 Industriële toepassingen 12 Zie ook 13 Referenties 14 Verdere lezing 15 Externe links [bewerken] Etymologie en geschiedenisEduard BuchnerReeds aan het einde van de 18e en vroege 19e eeuw, de spijsvertering van vlees door maagsecretie[7] en de omzetting er was bekend dat zetmeel tot suikers afkomstig van plant en speeksel afkomstig waren . [8] In de 19e eeuw kwam Louis Pasteur, toen hij de gistgisting van suiker naar alcohol bestudeerde, tot de conclusie dat deze gisting werd gekatalyseerd door een vitale kracht in de gistcellen, "gistcellen" genaamd, die alleen binnen levende organismen functioneerde. Hij schreef dat "alcoholische gisting een handeling is die gecorreleerd is met het leven en de organisatie van de gistcellen, niet met de dood of putrefactie van de cellen."[9] In 1877 gebruikte de Duitse fysioloog Wilhelm Kühne (1837-1900) voor het eerst het enzym dat voortkomt uit het voortbrengen van de behandeling μν, in leaven", om dit proces te beschrijven.[10] Het woord enzym werd later gebruikt om niet-levende stoffen zoals pepsine te noemen, en het woord ferment werd gebruikt om te verwijzen naar de chemische activiteit die door levende organismen wordt geproduceerd. In 1897 presenteerde Eduard Buchner zijn eerste artikel over de mogelijkheid van gistextracten die geen levende gistcellen bevatten, om suiker te gieten. In een reeks experimenten aan de Berlijnse kust stelde hij vast dat de suiker ook gefermenteerd was als er geen levende gistcellen in het mengsel waren[11]. Hij noemde het enzym dat de fermentatie van sucrose veroorzaakt "zymase"[12]. In 1907 ontving hij de Nobelprijs voor Chemie "voor zijn biochemisch onderzoek en zijn ontdekking van celvrije fermentatie". Na het voorbeeld van Buchner worden enzymen gewoonlijk genoemd op basis van de reactie die ze uitvoeren. Om de naam van een enzym te genereren, wordt het suffix-ase toegevoegd aan de naam van het substraat (zo is lactase bijvoorbeeld het enzym dat lactose reinigt) of het type reactie (bv. DNA-polymerase vormt DNA-polymeren).[13] Nadat is aangetoond dat enzymen buiten een levende cel kunnen functioneren, werd de biochemische natuur bepaald. Veel vroege werknemers merkten op dat enzymatische activiteit in verband werd gebracht met eiwitten, maar verscheidene wetenschappers (zoals Nobelprijswinnaar Richard Willstätter) stelden dat eiwitten slechts dragers van de echte enzymen waren en dat eiwitten op zich niet in staat waren om katalyse te ondergaan. Maar in 1926, James B. Sumner toonde aan dat het enzym urease een zuiver eiwit was en het kristalliseert; Sumner deed hetzelfde voor het enzym catalase in 1937. De conclusie dat zuivere eiwitten enzymen kunnen zijn, werd definitief bewezen door Northrop en Stanley, die werkzaam waren op de digestieve enzymen pepsine (1930), trypsine en chymotrypsine. Deze drie wetenschappers kregen de Nobelprijs voor Chemie uit 1946[14]. Deze ontdekking dat enzymen konden worden gekristalliseerd, maakte het uiteindelijk mogelijk dat hun structuren konden worden opgelost door middel van röntgenkristallografie. Dit werd voor het eerst gedaan voor lysozyme, een enzym dat voorkomt in tranen, speeksel en eiwit dat de coating van sommige bacteriën verstoort; De structuur werd door een groep onder leiding van David Chilton Phillips opgelost en in 1965 gepubliceerd.[15] Deze hoge-resolutiestructuur van lysozyme markeerde het begin van het gebied van de structurele biologie en de poging om te begrijpen hoe enzymen werken op atomair niveau. [geef] Structuren en mechanismen uit Zie ook: Enzyme- katalyseKoolstofdiagram met menselijke koolzuuranhydrase II. De grijze bol is de zinkcofactor op de actieve plaats. Uit de PDB 1MOO.Enzymen zijn doorgaans globale eiwitten en variëren van slechts 62 aminozuurresiduen in grootte, voor het monomeer van 4-oxalocrotonaat tautomerase[16] tot meer dan 2.500 residuen in het dierlijke vetzuursynthase.[17] Er bestaat een klein aantal biologische katalysatoren op basis van RNA, waarbij de meest voorkomende is de ribosomen; Deze worden RNA-enzymen of ribozymen genoemd. De werking van enzymen wordt bepaald door hun driedimensionale structuur[18]. Hoewel de structuur wel de functie bepaalt, is het voorspellen van de werking van een nieuw enzym enkel vanuit zijn structuur een zeer moeilijk probleem dat nog niet is opgelost.[19] De meeste enzymen zijn veel groter dan de substraten waarop zij werken, en slechts een klein deel van het enzym (ongeveer 3-4 aminozuren) is rechtstreeks betrokken bij katalyse[2]. [0] Het gebied dat deze katalytische residuen bevat, bindt het substraat en voert vervolgens de reactie uit is bekend als de actieve plaats. Enzymen kunnen ook plaatsen bevatten die cofactoren binden, die nodig zijn voor katalyse. Sommige enzymen hebben ook bindingsplaatsen voor kleine moleculen, die vaak directe of indirecte producten of substraten van de katalyse zijn. Deze binding kan dienen om de activiteit van het enzym te verhogen of te verminderen, wat een middel is om feedback te regelen. Zoals alle eiwitten zijn enzymen lange, lineaire ketens van aminozuren die zich vouwen tot een driedimensionaal product. Elke unieke aminozuursequentie produceert een specifieke structuur, die unieke eigenschappen heeft. Individuele eiwitketens kunnen soms samengroeien tot een eiwitcomplex. De meeste enzymen kunnen worden gedenatureerd — d.w.z. ontvouwd en geïnactiveerd — door verhitting of chemische denaturantia, die de driedimensionale structuur van het eiwit verstoren. Afhankelijk van het enzym kan denaturatie reversibel of irreversibel zijn. Structuren van enzymen in complex met substraten of substraatanalogen tijdens een reactie kunnen worden verkregen met behulp van Time-resolution crystallografie methoden. [uitgeven] Specificiteitenzymen zijn doorgaans zeer specifiek wat betreft de reacties die zij katalyseren en de substraten die bij deze reacties betrokken zijn. Deze specificiteit wordt veroorzaakt door aanvullende vorm, lading en hydrofiele/hydrofobe kenmerken van enzymen en substraten. Enzymen kunnen ook indrukwekkende stereospecificiteit, regionale selectiviteit en chemoselectiviteit shows[21] Sommige enzymen met de hoogste specificiteit en nauwkeurigheid zijn betrokken bij het kopiëren en weergeven van het genoom. Deze enzymen hebben "proefleesmechanismen". Dit tweestapproces resulteert in een gemiddelde foutenmarge van minder dan 1 fout in 100 miljoen reacties in polymerasen met hoge trouw[23]. Vergelijkbare mechanismen voor review worden ook gevonden in RNA-polymerase[24].] aminoacyl tRNA-synthetasen[25] en ribosomen.[26] Sommige enzymen die secundaire metabolieten produceren, worden als veelbelovend omschreven, omdat zij op een relatief breed scala van verschillende substraten kunnen werken. Er is gesuggereerd dat deze brede substraatspecificiteit belangrijk is voor de ontwikkeling van nieuwe biosynthetische routes[27] [bewerken] "Lock and key"-model Enzymen zijn zeer specifiek en de Nobelprijswinnaar voor organische chemie Emil Fischer stelde in 1894 voor dat dit komt doordat zowel het enzym als het substraat specifieke, elkaar aansluitende geometrische vormen hebben[2]. 8] Dit wordt vaak bedoeld als "het slot en het belangrijkste"model. Hoewel dit model de specificiteit van het enzym verklaart, geeft het geen verklaring voor de stabilisatie van de transitiestatus die enzymen bereiken. Diagrammen om de geïnduceerde fit hypothese van enzymwerking te shows.In 1958 stelde Daniel Koshland een wijziging van het slot- en sleutelmodel voor: Aangezien enzymen vrij flexibele structuren zijn, wordt de actieve plaats voortdurend hervormd door interacties met het substraat, aangezien het substraat interageert met het enzym[29]. de aminozuurzijketens waaruit de actieve locatie bestaat, worden gevormd in de exacte posities die het enzym in staat stellen zijn katalytische functie te vervullen. Bij sommige hoesjes, zoals glycosiden, verandert het substraatmolecuul ook enigszins in vorm naarmate het de actieve plaats ingaat.[30] De actieve plaats blijft veranderen totdat het substraat volledig gebonden is, op welk punt de uiteindelijke vorm en lading worden bepaald.[31] Induced fit kan de betrouwbaarheid van moleculaire herkenning in aanwezigheid van competitie en lawaai verbeteren door middel van het conformatiebevorderende mechanisme.[32] [bewerken] Mechanismen Enzymen kunnen op verschillende manieren werken, die allemaal lager zijn dan G‡:[33] Verlaging van de activeringsenergie door een omgeving te creëren waarin de overgangsstatus gestabiliseerd is (bv. door de vorm van een substraat te beïnvloeden — door de overgang-state-bevleesdheid van de substraat/productmoleculen te binden, vervormt het enzym het gebonden substraat(s) in hun overgangsvorm, waardoor de hoeveelheid energie die nodig is om de overgang te voltooien). Het verminderen van de energie van de overgangsstaat, maar zonder het substraat te verstoren, door een milieu met de tegenovergestelde tariefdistributie aan dat van de overgangsstaat te creëren. Een alternatieve route bieden. Bijvoorbeeld, tijdelijk reageren met het substraat om een intermediair ES-complex te vormen, wat zonder het enzym onmogelijk zou zijn. Het verminderen van de verandering van de reactieentropie door substraten in de correcte richtlijn samen te brengen om te reageren. Als je Η‡ alleen bekijkt, vergeet je dit effect. Verhoging van de temperaturen versnelt de reacties. De temperatuurstijging helpt het enzym dus beter te functioneren en het eindproduct nog sneller te ontwikkelen. Als het enzym echter te veel wordt verhit, gaat de vorm ervan achteruit en alleen wanneer de temperatuur weer normaal wordt, krijgt het enzym zijn vorm terug. Sommige enzymen zoals thermolabiele enzymen werken het best bij lage temperaturen. Interessant is dat dit entropisch effect destabilisatie van de toestand op de grond inhoudt[34] en dat de bijdrage ervan aan de katalyse relatief klein is.[35] [bewerken] Stabilisatie van de overgangsstaat Het inzicht in de oorsprong van de reductie van de aanwezigheid van G‡ vereist dat je uitzoekt hoe de enzymen hun transitiestatus meer kunnen stabiliseren dan de overgangsfase van de niet-katalytische reactie. Blijkbaar is de meest effectieve manier om tot een grote stabilisatie te komen het gebruik van elektrostatische effecten, met name door een relatief vaste polaire omgeving te hebben die gericht is op de ladingsverdeling van de overgangsfase[36]. Een dergelijke omgeving bestaat niet in de niet-katalyserende reactie in water. [geef] Dynamica en functie uit Zie ook: Eiwitdynamica De interne dynamiek van enzymen is gekoppeld aan hun katalysemechanisme[37][38][39] Interne dynamiek is de beweging van delen van de structuur van het enzym, zoals individuele aminozuurresiduen, een groep aminozuren of zelfs een volledig eiwitdomein. Deze bewegingen komen bij diverse tijd-schalen voor die zich van femtoseconden aan seconden uitstrekken. Netwerken van eiwitresiduen over de gehele structuur van een enzym kunnen bijdragen tot katalyse door middel van dynamische bewegingen[40][41][42][43] Eiwitbewegingen zijn van vitaal belang voor veel enzymen, maar of kleine en snelle trillingen of grotere en langzamere conformiteitbewegingen belangrijker zijn, hangt af van het soort reactie. Hoewel deze bewegingen belangrijk zijn voor het binden en vrijgeven van substraten en producten, is het niet duidelijk of de bewegingen van eiwitten de chemische stappen in enzymatische reacties helpen versnellen[44] Deze nieuwe inzichten hebben ook gevolgen voor het begrijpen van allogene effecten en het ontwikkelen van nieuwe geneesmiddelen. [Edit] Allostere modulatieAllostere overgang van een enzym tussen R- en T-staten, gestabiliseerd door een agonist, een remmer en een substraat (het MWC-model)Hoofdartikel: Allostere regulatie Allostere locaties zijn plaatsen op het enzym die zich binden aan moleculen in de cellulaire omgeving. De locaties vormen zwakke, niet-covalente bindingen met deze moleculen, waardoor de bevleesdheid van het enzym verandert. Deze verandering in de bevleesdheid vertaalt zich naar de actieve plaats, wat vervolgens de reactiesnelheid van het enzym beïnvloedt.[45] Allostere interacties kunnen enzymen remmen en activeren en zijn een gangbare manier om enzymen in het lichaam onder controle te houden.[46] Cofactoren en coenzymen Belangrijkste artikelen: Cofactor (biochemie) en Coenzyme [bewerken] Cofactoren Sommige enzymen hebben geen aanvullende bestanddelen nodig om de volledige activiteit van het show te garanderen. Andere vereisen echter niet-eiwitmoleculen, cofactoren genaamd, die gebonden zijn voor hun activiteit.[47] Cofactoren kunnen anorganisch zijn (bv. metalen ionen en ijzerzwavelclusters) of organische verbindingen (bv. flavine en heme). Organische cofactoren kunnen ofwel prothetische groepen zijn, die nauw gebonden zijn aan een enzym, ofwel co-enzymen, die tijdens de reactie vrijkomen van de actieve plaats van het enzym. Coenzymen zijn NADH, NADPH en adenosinetrifosfaat. Deze moleculen brengen chemische groepen over tussen enzymen.[48] Een voorbeeld van een enzym dat een cofactor bevat is koolzuuranhydrase en wordt in het bovenstaande koolstofdiagram getoond met een zinkcofactor die als onderdeel van zijn actieve locatie wordt gebonden.[49] Deze nauw gebonden moleculen worden gewoonlijk op de actieve plaats aangetroffen en zijn betrokken bij katalyse. Bijvoorbeeld, flavine- en hemelcofactoren zijn vaak betrokken bij redoxreacties. Enzymen die een cofactor nodig hebben maar er niet aan gebonden zijn, worden apoenzymen of apoproteinen genoemd. Een apoenzym wordt samen met de cofactor(en) een holoenzym genoemd (dit is de werkzame vorm). De meeste covalente factoren zijn niet covalent aan een enzym bevestigd, maar zijn zeer nauw gebonden. organische prothetische groepen kunnen echter covalent worden gebonden (bv. thiaminepyrofosfaat in het enzym pyruvaat dehydrogenase). De term "holoenzym" kan ook worden gebruikt voor enzymen die meerdere eiwitsubeenheden bevatten, zoals de DNA-polymerasen; hier is het holoenzym het complete complex dat alle subeenheden bevat die nodig zijn voor de activiteit . [uitgeven] CoenzymenSpaarvulmodel van het co-enzym NADHCoenzymen zijn kleine organische moleculen die chemische groepen van het ene enzym naar het andere vervoeren.[50] Sommige van deze chemische stoffen, zoals riboflavine, thiamine en foliumzuur, zijn vitaminen (verbindingen die niet door het lichaam kunnen worden gesynthetiseerd en die uit de voeding moeten worden verkregen). De vervoerde chemische groepen omvatten het hydride-ion (H-) dat wordt vervoerd door NAD of NADP+, de fosfaatgroep die wordt gedragen door adenosinetrifosfaat, de acetylgroep die wordt gedragen door coenzym A-, formyl-, methenyl- of methylgroepen die worden vervoerd door foliumzuur en de methylgroep die wordt vervoerd door S-adenosylmethionine. Omdat co-enzymen chemisch worden veranderd als gevolg van enzymatische werking, is het nuttig om co-enzymen te beschouwen als een speciale klasse van substraten, of tweede substraten, die veel verschillende enzymen gemeen hebben. Van ongeveer 700 enzymen is bijvoorbeeld bekend dat zij het co-enzym NADH gebruiken[51] Coenzymen worden gewoonlijk continu geregenereerd en hun concentraties worden op een constant niveau in de cel gehandhaafd: NADPH wordt bijvoorbeeld geregenereerd via de pentofosfaatroute en S-adenosylmethionine door methionine adenosyltransferase. Deze continue regeneratie betekent dat zelfs kleine hoeveelheden coenzymen zeer intensief worden gebruikt. Het menselijk lichaam draait bijvoorbeeld elke dag zijn eigen gewicht in ATP om.[52] [bewerken] ThermodynamicaDe energie van de fasen van een chemische reactie. Substraten hebben veel energie nodig om een transitiestatus te bereiken, die dan vervalt in producten. Het enzym stabiliseert de overgangstoestand, waardoor de energie die nodig is om producten te vormen wordt verminderd.Belangrijkste artikelen: Activeringsenergie, thermodynamisch evenwicht en chemisch evenwicht Zoals alle katalysatoren veranderen enzymen de positie van het chemisch evenwicht van de reactie niet. Gewoonlijk gaat de reactie in aanwezigheid van een enzym in dezelfde richting als zonder het enzym, net iets sneller. Door het ontbreken van het enzym kunnen echter andere mogelijke, niet-gekatalyseerde, "spontane" reacties tot verschillende producten leiden, omdat in die omstandigheden dit verschillende product sneller wordt gevormd. Bovendien kunnen enzymen twee of meer reacties koppelen, zodat een thermodynamisch gunstige reactie kan worden gebruikt om een thermodynamisch ongunstige reactie te "besturen". De hydrolyse van ATP wordt bijvoorbeeld vaak gebruikt om andere chemische reacties te sturen[53] Enzymen katalyseren de voor- en achterwaartse reacties op gelijke wijze. Zij veranderen het evenwicht zelf niet, maar alleen de snelheid waarmee het wordt bereikt. Zo katalyseert koolzuuranhydrase zijn reactie in beide richtingen, afhankelijk van de concentratie van de reagentia. (in weefsels; hoge CO2-concentratie) (in de longen; lage CO2-concentratie) Als het evenwicht echter sterk in één richting wordt verplaatst, d.w.z. als de reactie in een zeer ergonische reactie effectief onomkeerbaar is. Onder deze omstandigheden zal het enzym in feite alleen de reactie in de thermodynamisch toegestane richting katalyseren. [bewerken] Hoofdartikel Kinetics: Enzyme kineticsMechanism voor een enkele gesubstraat gekatalyseerde reactie. Het enzym (E) bindt een substraat (S) en produceert een product (P).Enzyme kinetiek is het onderzoek naar de manier waarop enzymen substraten binden en ze in producten veranderen. De snelheidsgegevens die bij kinetische analyses worden gebruikt, worden verkregen uit enzymebepalingen. In 1902 stelde Victor Henri[54] een kwantitatieve theorie voor van de enzymkinetiek, maar zijn experimentele gegevens waren niet bruikbaar omdat de significantie van de waterstofionconcentratie nog niet werd beoordeeld. Nadat Peter Lauritz Sørensen de logaritmische pH-schaal had gedefinieerd en in 1909 het bufferconcept had geïntroduceerd[55], herhaalden de Duitse chemicus Leonor Michaelis en zijn Canadese postdoc Maud Leonora Menten de experimenten van Henri en bevestigden hij zijn vergelijking, die Henri-Michaelis-Menten-kinetics wordt genoemd (soms ook Michaelis-Menten) Kinetica)[56] Hun werk is verder ontwikkeld door G. E. Briggs en J. B. S. Haldane, die kinetische vergelijkingen afgeleide, die nog steeds op grote schaal worden gebruikt[57] De belangrijkste bijdrage van Henri was dat in twee fasen aan enzymreacties werd gedacht. In de eerste plaats bindt het substraat zich reversibel aan het enzym, dat het enzym-substraat complex vormt. Dit wordt soms het Michaelis complex genoemd. Het enzym katalyseert vervolgens de chemische stap in de reactie en geeft het product vrij. Verzadigingskromme voor een enzymreactie die het verband aangeeft tussen de substraatconcentratie (S) en snelheid (v).Enzymen kunnen tot enkele miljoenen reacties per seconde katalyseren. Zo heeft de niet-gekatalyseerde decarboxylering van orotidine 5'-monofosfaat een halfwaardetijd van 78 miljoen jaar. Wanneer echter het enzym orotidine 5'-fosfaatdecarboxylase wordt toegevoegd, duurt hetzelfde proces slechts 25 milliseconden[58] Het enzymgehalte is afhankelijk van de oplosomstandigheden en de concentratie van het substraat. Voorwaarden die het eiwit denatureren, elimineren de enzymactiviteit, zoals hoge temperaturen, extremen van de pH of hoge zoutconcentraties, terwijl het verhogen van de substraatconcentratie de activiteit meestal verhoogt. Om de maximumsnelheid van een enzymatische reactie te bepalen, wordt de concentratie van het substraat verhoogd tot een constante snelheid van productvorming wordt waargenomen. Dit wordt getoond in de verzadigingskromme op het recht. Verzadiging gebeurt omdat naarmate de concentratie van het substraat stijgt, steeds meer van het vrije enzym wordt omgezet in de substraat-gebonden ES-vorm. Bij de maximale snelheid (Vmax) van het enzym worden alle actieve enzymplaatsen aan het substraat gebonden en is de hoeveelheid ES complex gelijk aan de totale hoeveelheid enzym. Vmax is echter slechts één kinetische constante van enzymen. De hoeveelheid substraat die nodig is om een bepaald reactiesnelheid te bereiken, is ook belangrijk. Dit wordt gegeven door de Michaelis-Menten constante (Km), de substraatconcentratie die nodig is om de helft van de maximumsnelheid van een enzym te bereiken. Elk enzym heeft een karakteristiek Km voor een bepaald substraat en dit kan show geven hoe dicht de binding van het substraat aan het enzym is. Een andere nuttige constante is kcat, dat is het aantal substraatmoleculen dat per seconde op één actieve plaats wordt behandeld. Het rendement van een enzym kan worden uitgedrukt in kcat/Km. Dit wordt ook genoemd de specificiteitsconstante en neemt de snelheidsconstanten voor alle stappen in de reactie op. Omdat de specificiteitsconstante zowel affiniteit als katalytische capaciteit weerspiegelt, is het nuttig om verschillende enzymen met elkaar te vergelijken, of hetzelfde enzym met verschillende substraten. Het theoretische maximum voor de specificiteitsconstante wordt de diffusiegrens genoemd en is ongeveer 108 tot 109 (M-1 s-1). Op dit punt zal elke botsing van het enzym met het substraat ervan resulteren in katalyse, en de snelheid van de productvorming wordt niet beperkt door de reactiesnelheid, maar door de diffusiesnelheid. Enzymen met deze eigenschap worden katalytisch perfect of kinetisch perfect genoemd. Voorbeelden van dergelijke enzymen zijn triofosfaatisomerase, koolzuuranhydrase, acetylcholinesterase, catalase, fumarase, β-lactamase en superoxidedismutase. Michaelis-Menten kinetics baseert zich op de wet van massale actie, die is gebaseerd op de veronderstellingen van vrije verspreiding en thermodynamisch gestuurde willekeurige botsing. Veel biochemische of cellulaire processen wijken echter sterk van deze omstandigheden af, vanwege de macromoleculaire verdringing, de fasescheiding van het enzym/substraat/product of een of tweedimensionale moleculaire beweging.[59] In deze situaties kan een fractale Michaelis-Menten-kinetiek worden toegepast.[60][61][62][63] Sommige enzymen werken met kinetica. een hogere dan de diffusiesnelheid, wat onmogelijk lijkt. Er zijn verschillende mechanismen gebruikt om dit verschijnsel uit te leggen. Van sommige eiwitten wordt aangenomen dat ze de katalyse versnellen door hun substraat in te tekenen en te pre-oriënteren door gebruik te maken van dipolaire elektrische velden. Bij andere modellen wordt een quantum-mechanische tunneling toegelicht, waarbij een proton of een elektron door activeringsbarrières kan tunnelen, hoewel dit model voor protonentunneling enigszins controversieel blijft.[64][65] Bij tryptamine is een kwantumtunnel voor protonen waargenomen.[66] Dit wijst erop dat enzymkatalyse nauwkeuriger kan worden gekarakteriseerd als "door de barrière" dan door traditioneel model, dat substraten verplicht om "over" een neerwaartse energiebarrière te gaan. [uitgeven] Inhibition Concurrerende remmers binden reversibel aan het enzym, waardoor de binding van het substraat wordt verhinderd. Aan de andere kant voorkomt binding van het substraat de binding van de remmer. Substraat en remmer concurreren voor het enzym. Soorten remming. Deze classificatie is ingevoerd door W.W. [67]Hoofdartikel: Enzyme remmer Enzyme-reactiesnelheden kunnen door verschillende typen enzymremmers worden verlaagd. Concurrerende remming Bij competitieve remming concurreren de remmer en het substraat om het enzym (d.w.z. dat zij niet tegelijkertijd kunnen binden)[68]. Bijvoorbeeld methotrexaat is een competitieve remmer van het enzym dihydrofolaat reductase, dat de reductie van dihydrofolaat tot tetrahydrofolaat katalyseert. De gelijkenis tussen de structuren van foliumzuur en dit geneesmiddel wordt in het cijfer rechts onderaan getoond. Merk op dat de binding van de remmer niet op de plaats van de substraat hoeft te zijn (zoals vaak vermeld), indien de binding van de remmer de bevleesdheid van het enzym verandert om de substraatbinding te voorkomen en omgekeerd. Bij competitieve remming is de maximale snelheid van de reactie niet veranderd, maar hogere substraatconcentraties zijn nodig om een bepaalde snelheid te bereiken, waardoor de schijnbare Km toeneemt. Niet-competitieve remming Bij niet-competitieve remming kan de remmer zich niet binden aan het vrije enzym, maar alleen aan het ES-complex. Het aldus gevormde EIS-complex is enzymatisch inactief. Dit type remming is zeldzaam, maar kan voorkomen in multimerieke enzymen. Niet-competitieve remming Niet-competitieve remmers kunnen zich gelijktijdig met het substraat aan het enzym binden, d.w.z. ze binden nooit aan de actieve plaats. Zowel de EI- als de EIS-complexen zijn enzymatisch inactief. Omdat de remmer niet door een hogere substraatconcentratie (in tegenstelling tot competitieve remming) uit het enzym kan worden aangedreven, verandert de zichtbare Vmax. Maar omdat het substraat nog steeds aan het enzym kan binden, blijft de Km hetzelfde. Gemengde remming Dit type remming lijkt op de niet-competitieve, behalve dat het EIS-complex een residuele enzymatische activiteit heeft. Bij veel organismen kunnen remmers werken als onderdeel van een terugkoppelingsmechanisme. Als een enzym te veel van één stof in het organisme produceert, kan die stof als remmer voor het enzym fungeren aan het begin van de weg die het produceert, waardoor de productie van de stof zal vertragen of stoppen wanneer er voldoende hoeveelheid is. Dit is een vorm van negatieve feedback. Enzymen die aan deze vorm van regulering onderworpen zijn, zijn vaak multimerisch en hebben legerbestendige bindingsplaatsen voor gereguleerde stoffen. Hun ondergrond/snelheidsterreinen zijn niet hyperbolair, maar sigmoïdaal (S-vormig).
Ontwerp van international designer
Store
Klant beoordelingen
4.4 van 5 sterren beoordeling72 aantal beoordelingen
72 Reviews
Beoordelingen voor identieke producten
5 van 5 sterren beoordeling
Door G.4 maart 2021 • Geverifieerde aankoop
Basic T-shirt, Wit, Volwassenen L
Zazzler recensent programma
Productkwaliteit is goed !
1 keer gewassen en laten strijken door een professionele strijk firma .
Resultaat = niet gekrompen en de afdruk is kleurvast .
Wellicht is het beter dat ik de volgende keer Maat L neem . Het ontwerp is zeer goed en de afdruk voldoet aan mijn verwachtingen .
4 van 5 sterren beoordeling
Door M.18 oktober 2012 • Geverifieerde aankoop
Basic T-shirt, Goud, Volwassenen L
Zazzler recensent programma
Het tshirt is van een stevige goede kwaliteit.
Hij viel alleen wel erg groot. Ik heb meestal XL
maar dit lijkt een Amerikaanse XL te zijn. Valt er groot. Ik heb nog niet getest hoe hij is na het wassen,
Maar de kwaliteit van de afdruk is goed.
5 van 5 sterren beoordeling
Door B.12 juni 2013 • Geverifieerde aankoop
Basic T-shirt, Wit, Volwassenen L
Creator beoordeling
helemaal oke, great t shirt nice, print i like. Geweldig netjes, nu al 20 x gewassen en in de droger en nog steeds goed
Tags
Andere Info
Product ID: 235973401797939589
Ontworpen op: 11-10-2010 22:07
Rating: G
Recent bekeken items