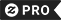Over Posters
Aangeboden door
Over dit ontwerp
No neon ink will be used when printing. Neon colors may appear darker than what you see on your screen.Bekijk echte folie producten
Rangorde van IUPAC-periodieke tabel van het Poster
De periodieke tabel van de chemische elementen (ook de tabel van Mendeleev, de periodieke tabel van de elementen of enkel de periodieke tabel) is een tabel met de chemische elementen. Hoewel de precursoren van deze tabel bestaan, wordt de uitvinding ervan in 1869 algemeen toegeschreven aan de Russische chemicus Dmitri Mendeleev, die de tabel bedoeld had om de terugkerende ("periodieke") trends in de eigenschappen van de elementen te illustreren. De indeling van de tabel is in de loop der tijd verfijnd en uitgebreid, aangezien nieuwe elementen zijn ontdekt en nieuwe theoretische modellen zijn ontwikkeld om het gedrag van chemische stoffen te verklaren. Het periodiek systeem is nu alomtegenwoordig in de academische discipline van de chemie, die een uiterst nuttig kader biedt om alle verschillende vormen van chemisch gedrag te classificeren, te systematiseren en te vergelijken. De tabel heeft een brede toepassing gevonden in de chemie, de fysica, de biologie en de techniek, met name de chemische techniek. In 1789 publiceerde Antoine Lavoisier een lijst van 33 chemische elementen. Hoewel Lavoisier de elementen in gassen, metalen, niet-metalen en aardmetalen heeft gegroepeerd, hebben chemici de volgende eeuw gezocht naar een nauwkeuriger classificatiesysteem. In 1829 merkte Johann Wolfgang Döbereiner op dat veel van de elementen op basis van hun chemische eigenschappen konden worden gegroepeerd in driehoekjes. Lithium, natrium en kalium werden bijvoorbeeld gegroepeerd als zachte, reactieve metalen. Döbereiner merkte ook op dat het tweede lid van elk triad, gerangschikt naar atomair gewicht, ongeveer het gemiddelde was van het eerste en het derde. Dit werd bekend als de wet van de triads. [citaat nodig] De Duitse chemicus Leopold Gmelin werkte met dit systeem. Tegen 1843 had hij tien triads geïdentificeerd, drie groepen van vier, en één groep van vijf. Jean Baptiste Dumas publiceerde in 1857 werk waarin relaties tussen verschillende metaalgroepen werden beschreven. Hoewel verschillende chemici relaties tussen kleine groepen elementen konden identificeren, moesten ze nog één project bouwen dat hen allemaal omvatte. De Duitse chemicus August Kekulé had in 1858 geconstateerd dat koolstof in verhouding van één tot vier neiging heeft om met andere elementen te verbinden. Methaan bijvoorbeeld heeft één koolstofatoom en vier waterstofatomen. Dit concept werd uiteindelijk bekend als valentie. In 1864 publiceerde de Duitse chemicus Julius Lothar Meyer een tabel met de 49 bekende elementen, gerangschikt naar valentie. De lijst openbaarde dat de elementen met gelijkaardige eigenschappen vaak de zelfde waarde deelden. De Engelse chemicus John Newlands publiceerde een serie artikelen in 1864 en 1865 waarin hij zijn poging beschreef om de elementen te classificeren: Als hij in de lijst wordt opgenomen in volgorde van toenemend atoomgewicht, werden er met intervallen van acht vergelijkbare fysische en chemische eigenschappen teruggevonden, die hij vergeleek met de muziekoctaven. Deze wet van octaves werd echter door zijn tegenstanders belachelijk gemaakt[8]. Portret van Dmitri Mendeleev, professor chemie in de Russische chemie Dmitri Ivanovich Mendeleev en Julius Lothar Meyer publiceerde hun periodieke tabellen onafhankelijk in respectievelijk 1869 en 1870. Beide hebben hun tabellen op een soortgelijke manier samengesteld: door de elementen in een rij of kolom in volgorde van atoomgewicht op te nemen en een nieuwe rij of kolom te beginnen toen de kenmerken van de elementen begonnen te herhalen. Het succes van de tafel van Mendeleev kwam van twee beslissingen die hij nam: de eerste was het laten van gaten in de tafel terwijl het leek dat het overeenkomstige element nog niet was ontdekt. Mendeleev was niet de eerste chemicus die dit deed, maar hij ging een stap verder door de trends in zijn periodiek systeem te gebruiken om de eigenschappen van die ontbrekende elementen, zoals gallium en germanium, te voorspellen. Het tweede besluit was om af en toe de volgorde te negeren die wordt voorgesteld door de atoomgewichten en aangrenzende elementen, zoals kobalt en nikkel, te veranderen om ze beter in chemische families te classificeren. Met de ontwikkeling van theorieën over de atoomstructuur werd duidelijk dat Mendeleev per ongeluk de elementen had opgesomd in volgorde van toenemend atoomaantal. Met de ontwikkeling van moderne quantummechanische theorieën van elektronenconfiguraties in atomen, werd duidelijk dat elke rij (of periode) in de tabel overeenkwam met de vulling van een kwantumschaal van elektronen. In de oorspronkelijke tabel van Mendeleev was elke periode dezelfde lengte. Maar omdat grotere atomen meer elektronensubschelpen hebben, hebben moderne tafels geleidelijk langere periodes verderop aan de tafel. In de jaren die volgden nadat Mendeleev zijn periodiek systeem had gepubliceerd, waren de gaten die hij achterliet gevuld toen chemici meer chemische elementen ontdekten. Het laatste natuurlijk voorkomende element dat moet worden ontdekt, was Francium (door Mendeleev aangeduid als eka-cesium) in 1939. Het periodiek systeem is ook gegroeid met de toevoeging van synthetische en transuranische elementen. Het eerste transuranische element dat ontdekt moet worden, was neptunium, dat gevormd werd door het bombarderen van uranium met neutronen in een cyclotron in 1939 "Periodic Table of Elements" Periodic Table of Elements Dmitri Mendeleev Antoine Lavoisier Chemistry Chemicals Physics Lab Laboratory Experiments Poster August Kekulé Chart Organic Biochemie Biochemische biologie Bioloog Samenstellingen Molecule Molecular Mole Avogadro Formule Symbol "Chemical Symbol" Atom Atomic "Atomic Weight" Proton Neutron Electron Deuterium Tritium Isotope Isomer Molarity Radioactive Nucleus Orbital Spin Quantum Row Period Actinium Aluminium Antimony Ari Arsenicum Astatine Barium Berkelium Beryllium Bismuth Bohrium Boron Bromine Cadmium Calcium Californium Carbon Cerium Cerium Cesium Chlorine Chromium Cobalt Copper Curium Darmstadtium Dubnium Dysprosium Einsteinium Erbium fermium fluorine Francium gmanium Gold Hafnium Halium Helium Holmium hydrogen Indium Iodine Iridium Iron Krypton Lawrencium Lead Lithium Lutetium Magnesium Mangaan Meitnerium Mendelevium Mercury Molybdenum Neodymium Neon Neptunium Nickel Niobium Nitrogen Nobelium Osmium Oxygen Palladium Phosphorme Platinum plonium politum kalium Praseodymium Promethium Protactinium Radium Radon Rhenium Rhodium Rubidium Ruthenium Rutherfordium Samarium Seaborgium selenium Silicon Silver Natrium Strontium Sulfur Tantalum Tellurium terbium Thorium Thorium Thulium TinTitanium Ununbium Unununununnilium Ununununumium Uranium vanadium Xenon Ytterbium Yttrium zink zirkonium
Ontwerp van international designer
Klant beoordelingen
4.8 van 5 sterren beoordeling26 aantal beoordelingen
26 Reviews
Beoordelingen voor identieke producten
5 van 5 sterren beoordeling
Door Pierre S.5 december 2016 • Geverifieerde aankoop
Custom (60,00cm x 40,00cm), Waarde posterpapier (halfglanzend)
Zazzler recensent programma
Mooi product, zeer goede kwaliteit. Voldoet helemaal aan de verwachting.
5 van 5 sterren beoordeling
Door I.5 november 2023 • Geverifieerde aankoop
20,3 x 25,4 cm, Waarde posterpapier (halfglanzend)
Zazzler recensent programma
Eindelijk de poster gevonden waar ik al een tijd naar op zoek was. Fijn dat ie ook ingelijst kon worden. Ik ben zeer tevreden met de kwaliteit van zowel de poster als de lijst.
5 van 5 sterren beoordeling
Door Rianne G.28 mei 2023 • Geverifieerde aankoop
Custom (27,94cm x 36,83cm), Waarde posterpapier (halfglanzend)
Zazzler recensent programma
Prachtig warm van kleur. Goede kwaliteit van papier. Netjes in een koker aangeleverd. Ben er heel blij mee. Is voor de verjaardag van een vriendin. Prachtig warm van kleur.
Tags
Andere Info
Product ID: 228301460283022176
Ontworpen op: 27-10-2011 20:29
Rating: G
Recent bekeken items